Báo Lao Động dẫn thông tin từ Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (bộ Y tế) cho biết dự kiến, vào ngày 29/8, Hội đồng sẽ tổ chức cuộc họp nhằm xem xét hồ sơ xin cấp phép cho 2 loại vaccine ngừa COVID-19, trong đó có vaccine Nanocovax của Việt Nam.
Hội đồng gồm các chuyên gia đầu ngành trong lĩnh vực Y, Dược; là các chuyên gia độc lập, hiện không trực tiếp giữ các nhiệm vụ quản lý nhà nước về dược. Trong đó, PGS.TS Lê Văn Truyền - nguyên Thứ trưởng bộ Y tế làm Chủ tịch Hội đồng.
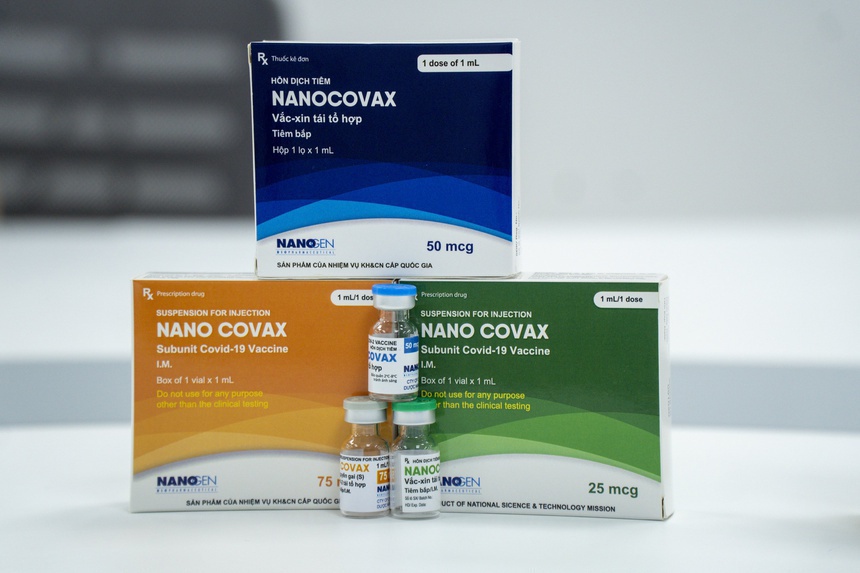
Theo Tri Thức Trực Tuyến, 2 loại vaccine sẽ được xem xét, đánh giá toàn bộ hồ sơ trong cuộc họp ngày 29/8 là Nanocovax của công ty Nanogen và vaccine Hayat-Vax sản xuất tại UAE, hợp tác, chuyển giao công nghệ từ Sinopharm của Trung Quốc.
Trước đó, trong 3 ngày 20-22/8, Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia (bộ Y tế) đã họp, thẩm định báo cáo giữa kỳ pha 3a vaccine Nanocovax, đánh giá về tính an toàn và tính sinh miễn dịch của vaccine. Kết quả, Hội đồng đã chấp thuận kết quả thử nghiệm lâm sàng giữa kỳ pha 3a vaccine Nanocovax.
Ngay sau khi được chấp thuận, hồ sơ và dữ liệu nghiên cứu của vaccine Nanocovax được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (bộ Y tế) để xem xét trước khi Bộ Y tế có quyết định cấp phép khẩn cấp có điều kiện với vaccine Nanocovax.
Theo hướng dẫn về đăng ký lưu hành vaccine COVID-19 sản xuất trong nước do bộ Y tế vừa ban hành, vaccine ngừa COVID-19 trong nước đang thử nghiệm lâm sàng được xem xét cấp giấy đăng ký lưu hành có điều kiện khi đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn và hiệu quả bảo vệ của vaccine, dựa trên dữ liệu về tính sinh miễn dịch của vaccine.
Việc này được thực hiện trên cơ sở ý kiến tư vấn của Hội đồng Đạo đức trong nghiên cứu y sinh học cấp quốc gia đối với thực hiện thử nghiệm lâm sàng tại Việt Nam và ý kiến tư vấn của Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với từng vaccine cụ thể, có tham khảo hướng dẫn hoặc khuyến cáo của Tổ chức Y tế thế giới (WHO).
Nếu được cấp phép, Nanocovax có thể sản xuất ngay 8-10 triệu liều/tháng và có thể nâng cấp lên 20-25 triệu liều/tháng. Giá nhà sản xuất cung cấp là 120.000 đồng/liều sau khi được trợ giá.
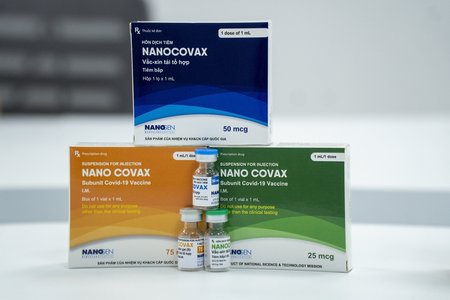
Vaccine Nanocovax sử dụng công nghệ protein tái tổ hợp, là vaccine đầu tiên của Việt Nam thử nghiệm lâm sàng đến pha 3. Đến nay, vaccine đã tiêm thử nghiệm gần 14.000 người, giai đoạn 3b đang tiếp tục được đánh giá.
Công ty Nanogen và nhóm nghiên cứu đã nhiều lần đề nghị xin cấp phép khẩn cấp có điều kiện cho vaccine Nano Covax. Với quan điểm chặt chẽ, khoa học, đặt tính mạng, sức khoẻ người dân lên hàng đầu, bộ Y tế yêu cầu nhà sản xuất hoàn thiện bộ dữ liệu để các hội đồng chuyên môn đánh giá.